Los estudios de transferencia pasiva han demostrado que los anticuerpos específicos contra el virus del PRRS son capaces de proteger a los animales frente a un desafío homólogo.
Sin embargo, el papel de las AN en el curso de la infección es un tema controvertido.
Si bien algunos autores han demostrado una cierta correlación entre la aparición de AN y el cese de la viremia o la eliminación del virus de los pulmones, otros estudios han sugerido que, para algunas cepas, la eliminación del virus en sangre puede ocurrir sin la presencia de AN; aún más, la viremia y la replicación viral pueden persistir incluso en presencia de AN.
En relación a la inmunidad mediada por células, algunos estudios han observado que, en ausencia de AN, el IFN-γ podría estar asociado a la eliminación del virus.
Protección frente la reinfección:
Como ya se ha discutido ampliamente, los niveles de AN después de la infección/vacunación con este virus suelen ser bajos o nulos.
De hecho, la eficacia de los AN frente a aislados heterólogos es muy limitada, ya que la neutralización cruzada (neutralización de una cepa concreta por los AN inducidos por otra cepa) puede ser baja incluso entre cepas muy similares.
Parece ser que la neutralización cruzada podría no estar estrictamente relacionada con las secuencias y/o el número de glicosilaciones en los epítopos neutralizantes conocidos de GP3, GP4 o GP5. Este hecho ha llevado a algunos autores a sugerir que quizás existan otros epítopos neutralizantes aún no conocidos.
De todas formas, como norma general sujeta a excepciones, cuanto mayor sea la cantidad de AN, mejor será la protección frente a una reinfección.
En términos de inmunidad mediada por células, varios estudios han relacionado, en ausencia de AN, las frecuencias altas de CP-IFN-γ con la protección clínica y virológica.
Este fenómeno ha sido descrito tanto en cerdas como en lechones, en términos de protección frente a trastornos reproductivos o respiratorios, respectivamente.
A pesar de ello, es importante señalar que, como se observa con los AN, la resolución de la viremia puede lograrse incluso sin un desarrollo aparente de CP IFN-γ.
Algunos estudios han demostrado que con niveles altos de AN y bajas respuestas de CP-IFN-γ después de la vacunación, los cerdos también pueden estar protegidos frente a un desafío.
El papel de los anticuerpos neutralizantes y de la inmunidad mediada por células en la eliminación del virus y en la protección. Algunos ejemplos:
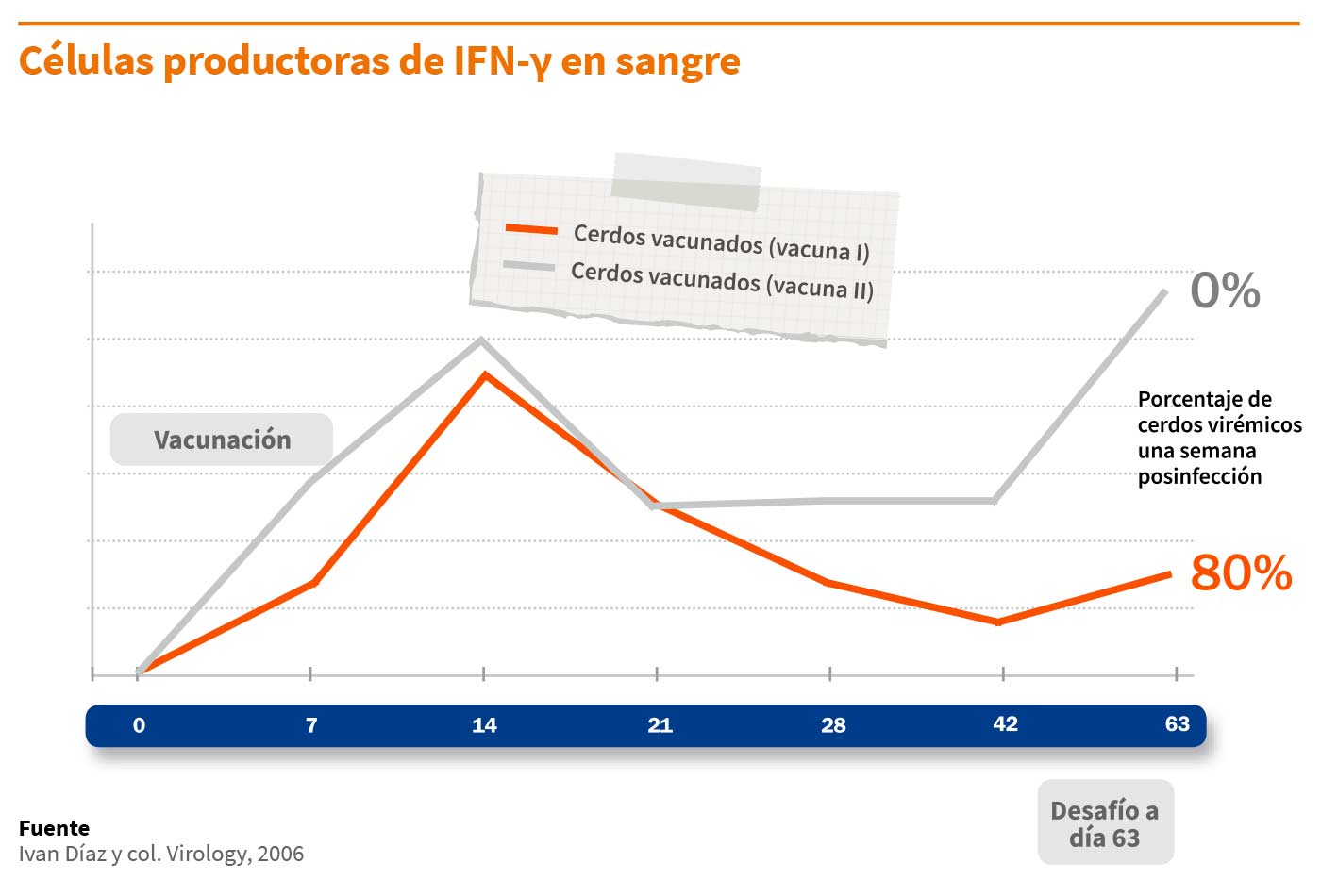
- Ejemplo I. Inmunidad mediada por células y anticuerpos neutralizantes en lechones vacunados.
Dos grupos de lechones fueron vacunados (vacuna I y II) y desafiados (cepa Ch).
Como era de esperar, los lechones vacunados no desarrollaron AN. En esta situación, probablemente fueron las CP-IFN-γ el principal mecanismo de protección frente a la infección.
La identidad genética entre las proteínas estructurales de las vacunas I y II y la cepa utilizada en el desafío fue superior al 90%. Sin embargo, fue mayor entre la vacuna I y Ch (98.3-99.7%) que entre la vacuna II y Ch (92.3-98.6%).
Curiosamente, en este caso, la cepa más diferente (II), heteróloga, proporcionó una mejor protección que la cepa más parecida (I), homóloga. Según los autores, este hecho podría explicarse por la capacidad de cada vacuna para inducir CP-IFN-γ específicas para el virus del PRRS. Fuente: Díaz y col. (2006).
- Ejemplo II. Inmunidad mediada por células en lechones vacunados (condiciones de campo):
Los lechones vacunados no estaban completamente protegidos contra la infección, pero la enfermedad cursó de forma menos grave. Curiosamente, se observaron puntuaciones de signos clínicos más altas y viremias más largas en aquellos animales con las respuestas más bajas de CPIFN-γ. Fuente: Martelli y col. (2009). - Ejemplo III. Inmunidad mediada por células y AN en desafíos homólogos y heterólogos:
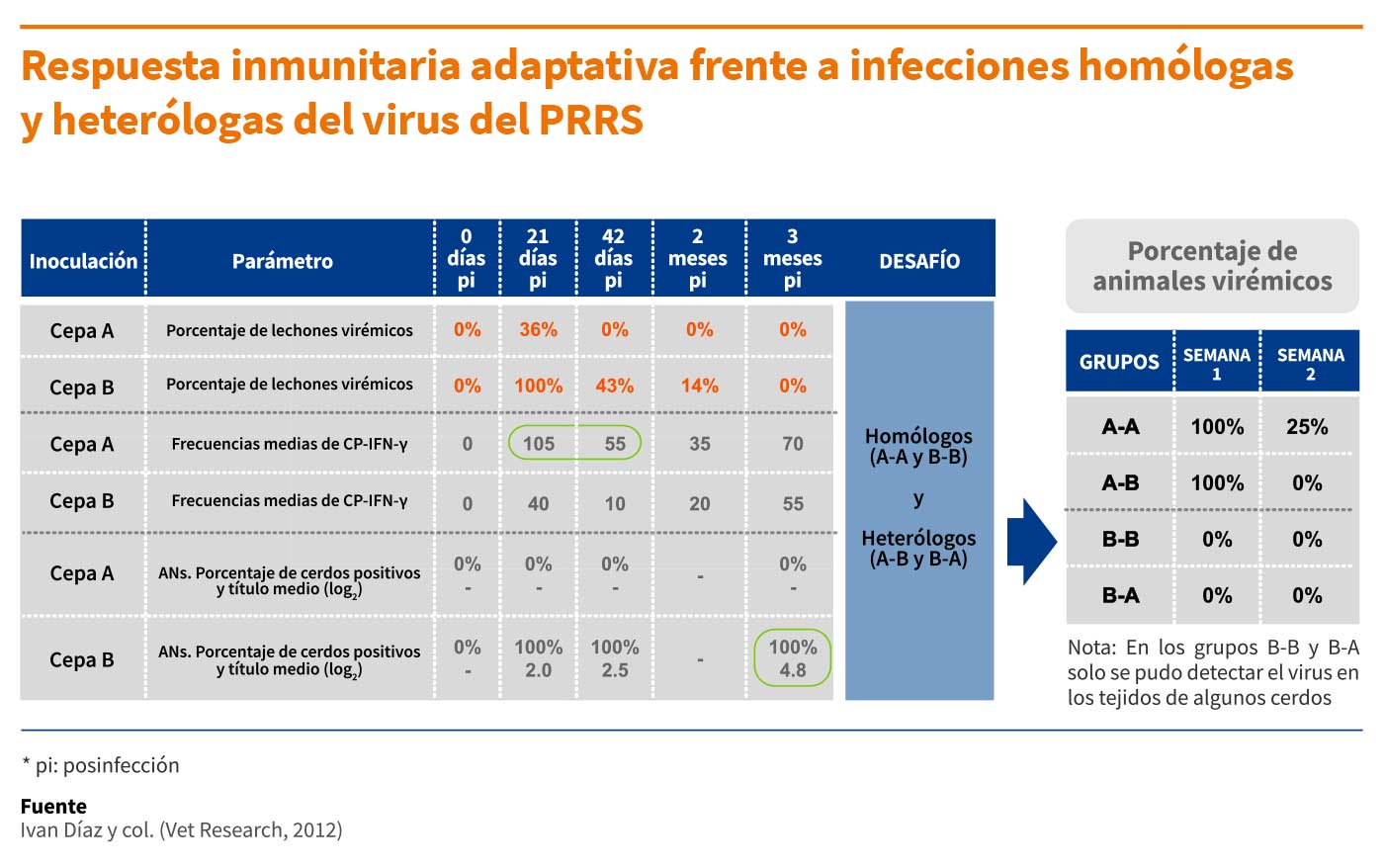
Con el fin de determinar la importancia de cada mecanismo en la protección frente al virus del PRRS, se caracterizaron las respuestas inmunitarias homólogas y heterólogas en lechones infectados. Para ello, se inoculó a un grupo de animales con la cepa A; tres meses más tarde se sometieron a un desafío con la cepa A o la cepa B (A-A y A-B) y se realizó un seguimiento durante las siguientes dos semanas. Por otro lado, otro grupo de cerdos se inoculó con la cepa B y a los tres meses se sometieron a un desafío con la cepa B o la A (B-B y B-A).
Los principales resultados y conclusiones que se extrajeron de este estudio fueron los siguientes:
- Eliminación del virus tras la infección: En los animales inoculados con la cepa A, la viremia cesó en ausencia de AN. En los animales inoculados con la cepa B, la viremia fue más larga y sostenida, y coexistió durante semanas con AN.
Por lo tanto, el papel de los AN en la eliminación de la viremia podría considerarse limitado. Con respecto a la inmunidad mediada por células, la cepa A indujo las frecuencias más altas de CP-IFN-γ. Dado que los AN no se detectaron en este grupo de animales, estos resultados indicarían que las CP-IFN-γ fueron las responsables de la eliminación del virus en la sangre. - Protección contra la reinfección: Después de la reinfección de los animales que previamente habían sido inoculados con la cepa B, desafío homólogo (B-B) o heterólogo (B-A), se detectó virus en los tejidos, pero no en la sangre.
Además, la infección en estos cerdos fue de menor intensidad que en los animales A-A y A-B.
Por tanto, a diferencia de la eliminación del virus tras la primera inoculación, los AN preformados parecían desempeñar un papel clave en la protección frente a la reinfección.
Nuevamente, dado que la cepa A no inducía AN, sino altas frecuencias de CP-IFN-γ, los datos indicarían que la inmunidad mediada por células podría ser la responsable de limitar la viremia y la propagación del virus a los tejidos en ausencia de AN.
En general, los resultados de este estudio sugerían que “los AN preformados pueden tener un papel protector frete a la infección, pero los animales que carecen de AN detectables pueden limitar la propagación de la infección, lo que indica que la inmunidad mediada por células probablemente también contribuye a la protección”.
© Laboratorios Hipra, S.A. 2024. Reservados todos los derechos.
Ninguna parte de este sitio web o cualquiera de sus contenidos puede ser reproducida, copiada, modificada o adaptada, sin el consentimiento previo por escrito de HIPRA.
- Bautista EM, Molitor TW. Cell-mediated immunity to porcine reproductive and respiratory syndrome virus in swine. Viral Immunol. 1997, 10: 83-94.
- Bautista EM, Molitor TW. IFN gamma inhibits porcine reproductive and respiratory syndrome virus replication in macrophages. Arch Virol. 1999, 144:1191-200.
- Butler JE, Lager KM, Golde W, Faaberg KS, Sinkora M, Loving C, Zhang YI. Porcine reproductive and respiratory syndrome (PRRS): an immune dysregulatory pandemic. Immunol Res. 2014, 59:81-108.
- Darwich L, Díaz I, Mateu E. Certainties, doubts and hypotheses in porcine reproductive and respiratory syndrome virus immunobiology. Virus Res. 2010, 154:123-32.
- Díaz I, Darwich L, Pappaterra G, Pujols J, Mateu E. Different European-type vaccines against porcine reproductive and respiratory syndrome virus have different immunological properties and confer different protection to pigs. Virology. 2006, 351:249-59.
- Díaz I, Gimeno M, Darwich L, Navarro N, Kuzemtseva L, López S, Galindo I, Segalés J, Martín M, Pujols J, Mateu E. Characterization of homologous and heterologous adaptive immune responses in porcine reproductive and respiratory syndrome virus infection. Vet Res. 2012, 19:43:30.
- Dwivedi V, Manickam C, Binjawadagi B, Linhares D, Murtaugh MP, Renukaradhya GJ. Evaluation of immune responses to porcine reproductive and respiratory syndrome virus in pigs during early stage of infection under farm conditions. Virol J. 2012, 9:45.
- Kimman TG, Cornelissen LA, Moormann RJ, Rebel JM, Stockhofe-Zurwieden N. Challenges for porcine reproductive and respiratory syndrome virus (PRRSV) vaccinology. Vaccine. 2009, 27:3704-18.
- Labarque GG, Nauwynck HJ, Van Reeth K, Pensaert MB. Effect of cellular changes and onset of humoral immunity on the replication of porcine reproductive and respiratory syndrome virus in the lungs of pigs. J Gen Virol. 2000, 81:1327-34.
- Lopez OJ, Osorio FA. Role of neutralizing antibodies in PRRSV protective immunity. Vet Immunol Immunopathol. 2004, 102:155-63.
- Lowe JE, Husmann R, Firkins LD, Zuckermann FA, Goldberg TL. Correlation of cell-mediated immunity against porcine reproductive and respiratory syndrome virus with protection against reproductive failure in sows during outbreaks of porcine reproductive and respiratory syndrome in commercial herds. J Am Vet Med Assoc. 2005, 226:1707-11.
- Lunney JK, Benfield DA, Rowland RR. Porcine reproductive and respiratory syndrome virus: an update on an emerging and re-emerging viral disease of swine. Virus Res. 2010, 154:1-6.
- Lunney JK, Fang Y, Ladinig A, Chen N, Li Y, Rowland B, Renukaradhya GJ. Porcine reproductive and respiratory syndrome virus (PRRSV): Pathogenesis and Interaction with the Immune System. Annu Rev Anim Biosci. 2016, 4:129-54
- Martelli P, Gozio S, Ferrari L, Rosina S, De Angelis E, Quintavalla C, Bottarelli E, Borghetti P. Efficacy of a modified live porcine reproductive and respiratory syndrome virus (PRRSV) vaccine in pigs naturally exposed to a heterologous European (Italian cluster) field strain: Clinical protection and cell-mediated immunity. Vaccine. 2009, 27:3788-99.
- Martínez-Lobo FJ, Díez-Fuertes F, Simarro I, Castro JM, Prieto C. Porcine Reproductive and Respiratory Syndrome Virus isolates differ in their susceptibility to neutralization. Vaccine. 2011, 29:6928-40.
- Mateu E, Diaz I. The challenge of PRRS immunology. Vet J. 2008, 177:345-51.
- Meier WA, Galeota J, Osorio FA, Husmann RJ, Schnitzlein WM, Zuckermann FA. Gradual development of the interferon-gamma response of swine to porcine reproductive and respiratory syndrome virus infection or vaccination. Virology. 2003, 309:18-31.
- Mengeling WL, Lager KM, Vorwald AC, Koehler KJ. Strain specificity of the immune response of pigs following vaccination with various strains of porcine reproductive and respiratory syndrome virus. Vet Microbiol. 2003, 93:13-24.
- Miranda J, Torrents D, Busquet M, Fenech M, Mateu E, Díaz I. Heterologous cell-mediated immune responses against PRRS virus in gilts vaccinated intramuscularly and intradermally with UNISTRAIN® PRRS. 2015, 7th International Symposium on Emerging and Re-emerging Pig Diseases.
- Murtaugh MP, Xiao Z, Zuckermann F. Immunological responses of swine to porcine reproductive and respiratory syndrome virus infection. Viral Immunol. 2002, 15:533-47.
- Murtaugh MP, Genzow M. Immunological solutions for treatment and prevention of porcine reproductive and respiratory syndrome (PRRS). Vaccine. 2011, 29:8192-204.
- Murtaugh MP, Stadejek T, Abrahante JE, Lam TT, Leung FC. The ever-expanding diversity of porcine reproductive and respiratory syndrome virus. Virus Res. 2010, 154:18-30.
- Rose N, Renson P, Andraud M, Paboeuf F, Le Potier MF, Bourry O. Porcine reproductive and respiratory syndrome virus (PRRSv) modified-live vaccine reduces virus transmission in experimental conditions. Vaccine. 2015, 33:2493-9.
- Pileri E, Gibert E, Soldevila F, García-Saenz A, Pujols J, Diaz I, Darwich L, Casal J, Martín M, Mateu E. Vaccination with a genotype 1 modified live vaccine against porcine reproductive and respiratory syndrome virus significantly reduces viremia, viral shedding and transmission of the virus in a quasi-natural experimental model. Vet Microbiol. 2015, 175:7-16.
- Prieto C, Alvarez E, Martínez-Lobo FJ, Simarro I, Castro JM. Similarity of European porcine reproductive and respiratory syndrome virus strains to vaccine strain is not necessarily predictive of the degree of protective immunity conferred. Vet J. 2008, 175:356-63.
- Roca M, Gimeno M, Bruguera S, Segalés J, Díaz I, Galindo-Cardiel IJ, Martínez E, Darwich L, Fang Y, Maldonado J, March R, Mateu E. Effects of challenge with a virulent genotype II strain of porcine reproductive and respiratory syndrome virus on piglets vaccinated with an attenuated genotype I strain vaccine. Vet J. 2012, 193:92-6.
- Royaee AR, Husmann RJ, Dawson HD, Calzada-Nova G, Schnitzlein WM, Zuckermann FA, Lunney JK. Deciphering the involvement of innate immune factors in the development of the host response to PRRSV vaccination. Vet Immunol Immunopathol. 2004, 102:199-216.
- Scortti M, Prieto C, Martínez-Lobo FJ, Simarro I, Castro JM. Effects of two commercial European modified-live vaccines against porcine reproductive and respiratory syndrome viruses in pregnant gilts. Vet J. 2006, 172:506-14.
- Weesendorp E, Morgan S, Stockhofe-Zurwieden N, Popma-De Graaf DJ, Graham SP, Rebel JM. Comparative analysis of immune responses following experimental infection of pigs with European porcine reproductive and respiratory syndrome virus strains of differing virulence. Vet Microbiol. 2013, 163:1-12.
- Yoon KJ, Wu LL, Zimmerman JJ, Platt KB. Field isolates of porcine reproductive and respiratory syndrome virus (PRRSV) vary in their susceptibility to antibody dependent enhancement (ADE) of infection. Vet Microbiol. 1997, 55:277-87.
- Zimmerman JJ, Benfield DA, Dee SA, Murtaugh MP, Stadejek T, Stevenson GW, Torremorell M. Porcine reproductive and respiratory syndrome virus (porcine arterivirus). In: 10th ed. Diseases of swine, Ed. Wiley-Blackwell. 2012, 31:463-86.

 Todos los derechos reservados. © HIPRA
Todos los derechos reservados. © HIPRA
